독감과 감기의 차이점, 고열과 근육통 있다면 의심해야
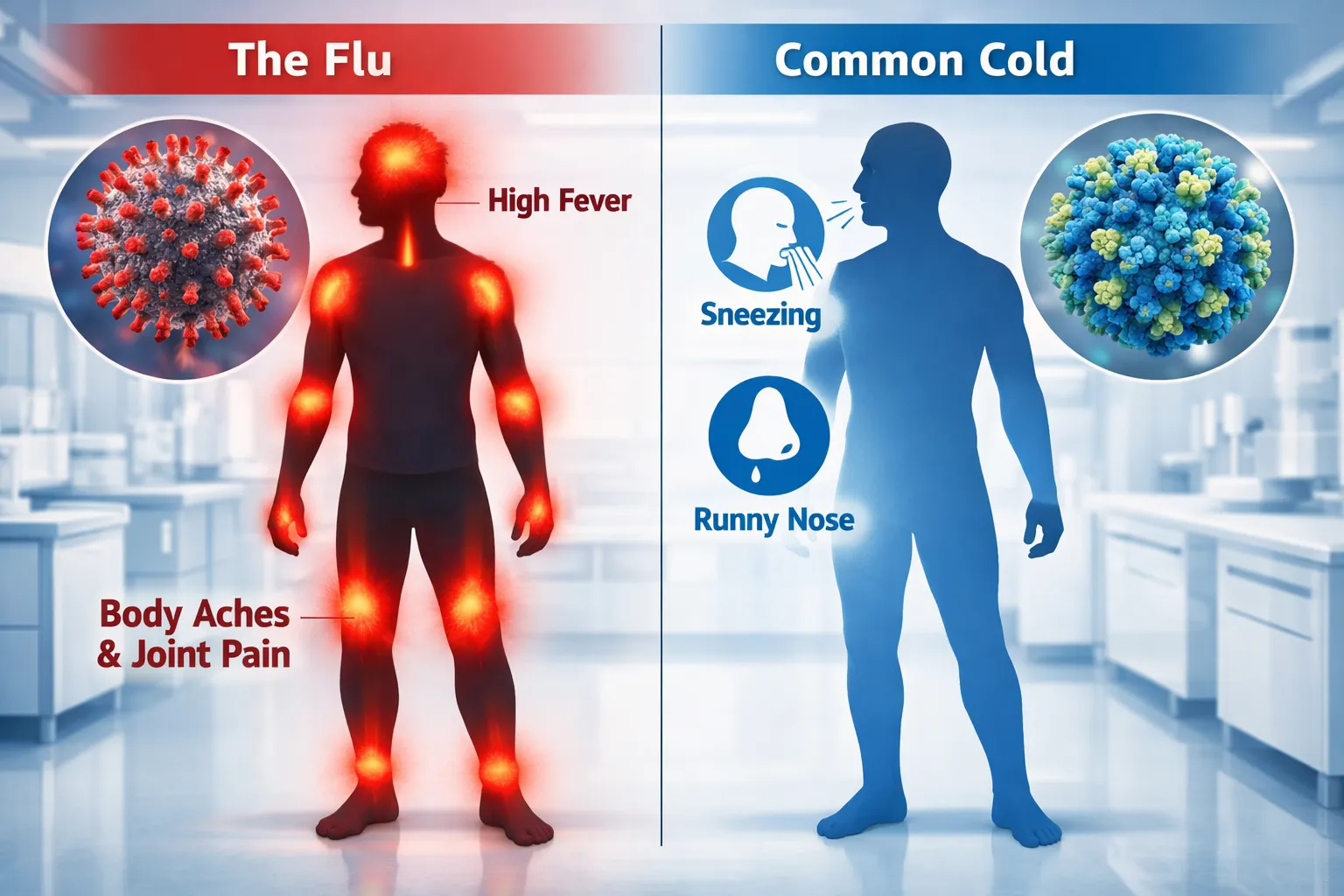
독감과 감기는 호흡기 질환이라는 공통점 때문에 혼동하기 쉽지만 원인균부터 증상의 강도까지 확연히 다른 질병입니다. 감기는 200여 종 이상의 다양한 바이러스에 의해 발생하는 반면 독감은 인플루엔자 바이러스라는 특정 바이러스가 원인이 되어 나타납니다. 감기는 사계절 내내 걸릴 수 있지만 독감은 주로 겨울부터 이듬해 봄까지 유행하는 계절성 특징을 보이며 전염력이 훨씬 강해 사회적 관리가 필요한 질환으로 분류됩니다. 증상 면에서 감기는 서서히 나타나며 주로 코와 목에 국한된 증상을 보입니다. 콧물과 재채기 그리고 가벼운 인후통이나 기침이 주된 증상이며 발열이 있더라도 대개 미열에 그치는 경우가 많습니다. 반면 독감은 어느 날 갑자기 시작되는 고열과 함께 심한 근육통 및 오한 그리고 전신 쇠약감이 동반되는 것이 특징입니다. 일상생활이 불가능할 정도의 피로감과 두통이 몰려온다면 감기보다는 독감을 의심해 보아야 합니다. 두 질환은 회복 기간과 합병증의 위험도에서도 큰 차이를 보입니다. 일반적인 감기는 충분한 휴식과 영양 섭취만으로도 일주일 이내에 자연스럽게 호전되는 경우가 대부분입니다. 하지만 독감은 증상이 일주일 이상 지속될 수 있으며 적절한 치료가 이뤄지지 않을 경우 폐렴이나 심근염 같은 치명적인 합병증으로 이어질 수 있습니다. 특히 노약자나 기저질환자에게 독감은 단순한 유행병 이상의 생명 위협이 될 수 있어 주의가 필요합니다. 치료 방법 또한 각각의 특성에 맞춰 다르게 적용됩니다. 감기는 특별한 치료제라기보다는 콧물이나 기침 같은 증상을 완화하는 대증요법을 주로 사용하며 몸의 면역력이 스스로 이겨내도록 돕는 방식입니다. 그러나 독감은 인플루엔자 바이러스를 억제하는 항바이러스제를 복용해야 증상을 빠르게 완화하고 전염 기간을 단축할 수 있습니다. 증상 발현 후 48시간 이내에 약물을 투여하는 것이 가장 효과적이라고 알려져 있습니다. 예방 측면에서 볼 때 독감은 백신이라는 강력한 대응 수단이 존재합니다. 감기는 원인 바이러스가 너무 많아 백신을 만들기 어렵지만 독감은 매년 유행할 바이러스를 예측하여 백신을 생산하므로 예방 접종을 통해 감염 확률을 낮추거나 감염 시 증상을 완화할 수 있습니다. 개인위생 수칙인 손 씻기와 마스크 착용은 두 질환 모두를 예방하는 데 효과적이지만 독감만큼은 정기적인 접종이 가장 권장되는 예방책입니다. 결론적으로 독감과 감기를 정확히 구분하는 것은 적절한 치료를 받고 심각한 합병증을 막는 첫걸음입니다. 갑작스러운 고열과 전신 통증이 나타난다면 단순 감기로 치부하여 방치하지 말고 즉시 의료기관을 방문해 검사를 받아야 합니다. 자신의 상태를 정확히 파악하고 올바른 대처를 하는 것이 겨울철 건강을 지키고 주변 사람들에게 바이러스를 전파하지 않는 가장 현명한 방법입니다.